Бор (лат. Borum), В, хімічний елемент III групи періодичної системи Менделєєва, атомний номер 5, атомна маса 10,811; кристали сірувато-чорного кольору (дуже чистий Б. безбарвний). Природний Б. складається з двох стабільних ізотопів: 10B (19%) і 11B (81%). Раніше інших відоме з'єднання Б. - бура - згадується в творах алхіміків під арабською назвою «буряк» і латинським Borax, звідки й походить найменування «бор». Вільний Б. (нечистий) вперше отримали французькі хіміки Ж. Гей-Люссак і Л. Тенар в 1808 нагріванням борного ангідриду B2O3 з металевим калієм. Загальний вміст Б. в земній корі 3 • 10-4% по масі. У природі Б. у вільному стані не виявлено. Багато з'єднання Б. широко поширені, особливо в невеликих концентраціях. У вигляді боросилікат, боратов, бороалюмосілікатов, а також як ізоморфна домішка в інших мінералах Б. входить до складу багатьох вивержених і осадових порід. З'єднання Б. знайдені в нафтових водах, морській воді, соляних озерах, гарячих джерелах, в вулканічних і сопкових грязі, в багатьох грунтах. Про головні природних з'єднаннях Б., службовців для його промислового отримання, див. В ст. борати природні .
Фізичні та хімічні властивості. Відомо кілька кристалічних модифікацій Б. Для двох з них рентгеноструктурньїм аналізом вдалося повністю визначити кристалічну структуру, яка в обох випадках виявилася вельми складною. Атоми Б. утворюють в цих структурах тривимірний каркас подібно атомам вуглецю в алмазі. Цим пояснюється висока твердість Б. Однак будова каркаса в структурах Б. набагато складніше, ніж в алмазі. Основною структурною одиницею в кристалах Б. служать двадцатигранник (ікосаедр), в вершинах кожного з яких знаходяться 12 атомів Б. (рис., А). Ікосаедр з'єднуються між собою як безпосередньо (рис., Б), так і за допомогою нейтральних атомів Б., що не входять до складу будь-якого ікосаедра (рис., В). При такій будові виявляється, що атоми Б. в кристалах мають різні координаційні числа: 4, 5, 6 і 5 + 2 (5 ближніх «сусідів» і 2 більш далеких). Т. к. На зовнішній оболонці атома Б. знаходяться всього 3 електрона (електронна конфігурація 2s22p), на кожну присутню в кристалічному Б. зв'язок доводиться істотно менше двох електронів. Відповідно до сучасних уявлень, в кристалах Б. здійснюється особливий тип ковалентного зв'язку - багатоцентрових зв'язок з дефіцитом електронів. У з'єднаннях іонного типу Б. 3-валентний. Так званий «аморфний» Б., одержуваний при відновленні B2O3 металевим натрієм або калієм, має щільність 1,73 г / см 3. Чистий кристалічний Б. має щільність 2,3 г / см 3, температуру плавлення 2075 ° С, температуру кипіння 3860 ° С; твердість Б. за мінералогічною шкалою 9, мікротвердість 34 Гн / м 2 (3400 кгс / мм 2). Кристалічний Б. - напівпровідник. У звичайних умовах він проводить електричний струм погано. При нагріванні до 800 ° С електрична провідність Б. збільшується на кілька порядків, причому знак провідності змінюється (електронна - при низьких температурах, діркова - при високих) (див. напівпровідникові матеріали ).
Хімічно Б. при звичайних умовах досить інертний (взаємодіє активно лише з фтором), причому кристалічний Б. менш активний, ніж аморфний. З підвищенням температури активність Б. зростає і він з'єднується з киснем, сіркою, галогенами. При нагріванні на повітрі до 700 ° С Б. горить червоним полум'ям, утворюючи борний ангідрид B2O3 - безбарвну склоподібну масу. При нагріванні вище 900 ° С Б. з азотом утворює бору нітрид BN, при нагріванні з вугіллям - бору карбід B4C, з металами - бориди . З воднем Б. помітно не реагує; його гідриди ( Бороводні ) Отримують непрямим шляхом. При температурі червоного розжарювання Б. взаємодіє з водяною парою: 2B + 3Н2О = B2O3 + 3H2. У кислотах Б. при звичайній температурі не розчиняється, крім концентрованої азотної кислоти, яка окисляє його до борної кислоти H3BO3. Повільно розчиняється в концентрованих розчинах лугів з утворенням боратов.
У фториді BF3 і інших галогенидах Б. пов'язаний з галогенами трьома ковалентними зв'язками. Оскільки для завершення стійкої 8-електронної оболонки атома Б. в галогеніди BX3 бракує пари електронів, молекули галогенідів, особливо BFз, приєднують молекули інших речовин, що мають вільні електронні пари, наприклад аміаку
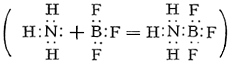
У таких комплексних з'єднаннях атом Б. оточений чотирма атомами (або групами атомів), що відповідає характерному для Б. в його з'єднаннях координаційному числу 4. Важливі комплексні сполуки Б. - борогідріда , Наприклад Na [BH4], і фтороборная, або борофторістоводородная, кислота H [BF4], що утворюється з BF3 і HF; більшість солей цієї кислоти (фтороборатов) розчинні у воді (за винятком солей К, Rb, Cs). Загальна особливість самого Б. і його з'єднань - їх схожість з кремнієм і його сполуками. Так, борна кислота, подібно кремнієвої, має слабкі кислотні властивості і розчиняється в HF з утворенням газоподібного BF3 (кремнієва дає SiF4). Бороводні нагадують кремневодороди, а карбід Б. - карбід кремнію, і т.д. Цікавим є особливе схожість модифікацій нітриду BN з графітом або алмазом. Це пов'язано з тим, що атоми В і N по електронній конфігурації спільно імітують 2 атома С (у В - 3 валентних електрона, у N - 5, у двох атомів С - по 4). Ця аналогія характерна і для інших сполук, що містять одночасно Б. і азот. Так, Боразан BH3-NH3 подібний етану СН3-СН3, а боразен BH2 = NH2 і найпростіший боразін BH º NH подібні відповідно етилену СН2 = СН2 і ацетилену CH º CH. Якщо тримеризация ацетилену C2H2 дає бензол C6H6, то аналогічний процес призводить від боразіна BHNH до боразолу B3N3H6 (див. Також борорганічні з'єднання ).
Отримання і застосування. Елементарний Б. з природної сировини отримують в кілька стадій. Розкладанням боратов гарячою водою або сірчаною кислотою (в залежності від їх розчинності) отримують борну кислоту, а її зневодненням - борний ангідрид. Відновлення В2О3 металевим магнієм дає Б. у вигляді темно-бурого порошку; від домішок його очищають обробкою азотної і плавикової кислотами. Дуже чистий Б., необхідний у виробництві напівпровідників, отримують з його галогенідів: відновлюють BCl3 воднем при 1200 ° С або розкладають пари BBr3 на танталовой дроті, розпеченій до 1500 ° С. Чистий Б. отримують також термічним розкладанням бороводородов.
Б. в невеликих кількостях (частки%) вводять в сталь і деякі сплави для поліпшення їх механічних властивостей; вже присадка до стали 0,001-0,003% Б. підвищує її міцність (зазвичай в сталь вводять Б. у вигляді ферробор , Т. Е. Сплаву заліза з 10-20% Б.). Поверхневе насичення сталевих деталей бором (до глибини 0,1-0,5 мм) покращує не тільки механічні властивості, але і стійкість стали проти корозії (див. борирование ). Завдяки здатності ізотопу 10В поглинати теплові нейтрони, його застосовують для виготовлення регулюючих стрижнів ядерних реакторів , Службовців для припинення або уповільнення реакції поділу. Б. у вигляді газоподібного BF3 використовують в лічильниках нейтронів. (При взаємодії ядер 10В з нейтронами утворюються заряджені a-частинки, які легко реєструвати; число ж a-частинок дорівнює числу нейтронів, що надійшли в лічильник: 105B + 10 n = 73Li + 42 a) (див. Також Нейтронні детектори і індикатори ). Сам Б. і його сполуки - нітрид BN, карбід B4C, фосфід ВР і ін. - застосовують як діелектрики і напівпровідникові матеріали. Широке застосування знаходять борна кислота і її солі (насамперед бура), борид і ін. BF3 - каталізатор деяких органічних реакцій.
Літ .: Некрасов Б. В., Основи загальної хімії, т. 2, М., 1967; Щукарев С. А., Лекції з курсу загальної хімії, т. 2, Л., 1964; Бор, його з'єднання і сплави, К., 1960.
В. Л. Василевський.
Б. в організмі. Б. належить до хімічних елементів, які в дуже малих кількостях містяться в тканинах рослин і тварин (тисячні і десятитисячні частки% на суху масу). Б. необхідний для підтримки нормальної життєдіяльності рослин. Найважливіший симптом нестачі Б. - відмирання точки росту головного стебла, а потім і пазушних бруньок. Одночасно черешки і листя стають крихкими, квітки не з'являються або не утворюються плоди; тому при нестачі Б. падає урожай насіння. Відомі багато хвороб, пов'язані з недоліком Б., наприклад гниль сердечка цукрового буряка, чорна плямистість столового буряка, побуріння серцевини брукви і цвітної капусти, засихання верхівки льону, жовтяниця верхівки люцерни, бура плямистість абрикос, обкоркування яблук. При нестачі Б. сповільнюється окислення цукрів, амінування продуктів вуглеводного обміну, синтез клітинних білків; однак ферменти, для яких Б. є необхідним елементом, поки невідомі. За даними М. Я. Школяра, при нестачі Б. у рослин знижується вміст АТФ, а також порушується процес окисного фосфорилювання , Внаслідок чого енергія, що виділяється при диханні, не може бути використана для синтезу необхідних речовин. При нестачі Б. в грунті в неї вносять борні добрива (див. Мікродобрива ). В біогеохімічних провінціях з надлишком Б. в грунті (наприклад, в Північно-Західному Казахстані) виникають морфологічні зміни і захворювання рослин, що викликаються накопиченням Б., - гігантизм, карликовість, порушення точок зростання і ін. На грунтах з інтенсивним борним засоленням зустрічаються ділянки, позбавлені рослинності, «лисини», - один з пошукових ознак родовища Б. значення Б. в організмі тварин поки не з'ясовано. У людини і тварин (овець, верблюдів) при харчуванні рослинами з надмірним вмістом Б. (60-600 мг / кг сухої речовини і більш) порушується обмін речовин (зокрема, активність протеолітичних ферментів) і з'являється ендемічне захворювання шлунково-кишкового тракту - борний ентерит.
Літ .: Скок Дж., Функція бору в рослинній клітині, в кн .: Мікроелементи, пер. з англ., М., 1962; Ковальський В. В., Ананичев А. В., Шахова І. К., Борна биогеохимическая провінція Північно-Західного Казахстану, «Агрохімія», 1965, № 11.
В. В. Ковальський.
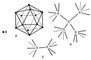
Малюнок до ст. Бор (химич. Елемент).



